Publié le 20.09.2021
En médecine, certains mondes ne se rencontrent pas. C’est le cas des maladies mitochondriales et des interféronopathies. Les premières sont des maladies génétiques provoquant un défaut métabolique des mitochondries, structures cellulaires qui produisent l’énergie nécessaire au bon fonctionnement de la cellule. Les maladies mitochondriales affectent principalement le système nerveux et les muscles. Les secondes sont liées à une production anormale d’interférons, protéines qui constituent la première barrière immunologique contre les infections virales. Elles touchent en particulier le cerveau et la peau. Or, dans une nouvelle étude publiée dans le Journal of Experimental Medicine (JEM), l’équipe de Yanick Crow, directeur du laboratoire de neurogénétique et neuroinflammation à l’Institut Imagine, a établi un nouveau lien entre ces deux classes de maladies chez des patients portant des mutations dans une protéine mitochondriale, dont deux patients atteints de sclérodermie systémique, une affection rare de la peau. Cette découverte fait écho à une question brûlante qui agite la communauté scientifique : et si ces deux familles de maladies étaient en partie liées ?
La perméabilisation des mitochondries en cause
Cette hypothèse suscite l’enthousiasme car elle offre un nouvel angle dans la compréhension de ces pathologies. « C’est un domaine de recherche en plein essor », confirme Alice Lepelley, première auteure de cette étude et immunologiste dans l’équipe de Yanick Crow. Dès 2014, des biologistes de Yale University et de l’université de Melbourne avaient ainsi établi un lien fondamental entre dommage mitochondrial et production d'interférons. Dans des expérimentations réalisées in vitro, ils avaient montré qu’en stressant des mitochondries, celles-ci se perméabilisent, laissant s’échapper leurs acides nucléiques (ADN ou ARN) dans le cytoplasme. « Or, la présence de ces séquences génétiques au mauvais endroit conduit à une activation inappropriée de la réponse antivirale et une production d’interféron de type 1 », explique la chercheuse. En effet, les récepteurs habituellement en charge de repérer la présence d’acides nucléiques de microbes (ARN ou ADN viral) considèrent ces acides nucléiques mitochondriaux comme étrangers, engendrant une réponse immunitaire anormale.
Il a toutefois fallu attendre 2018 pour confirmer la validité de ce mécanisme potentiellement délétère chez des patients. Cette découverte avait d’ailleurs fait l’objet d’une publication dans la revue Nature, cosignée par Agnès Rötig, directrice du laboratoire de génétique des maladies mitochondriales, à l’Institut Imagine, Arnold Munnich, actuel président de la Fondation Imagine, et Yanick Crow. Les chercheurs avaient alors montré qu’une maladie mitochondriale liée à une mutation du gène PNPT1 provoque la libération d’ARN hors des mitochondries. De ce fait, les patients produisent une quantité très importante d’interférons de type 1, ce qui peut déclencher une inflammation incontrôlée. Cette maladie, considérée au départ comme une maladie mitochondriale, pouvait donc aussi être vue comme une interféronopathie !
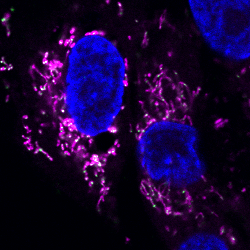
Quand la libération d'ADN mitochondrial déclenche l'inflammation
Dans cette nouvelle étude parue dans JEM, deux patients étaient suivis dans les services de rhumatologie de l’Hôpital Necker-Enfants Malades et de l’hôpital universitaire de Louvain pour une sclérodermie systémique, une maladie rare de la peau associée à une production anormale d’interférons et liée à une autoimmunité. Dupé, l’organisme déclenche une réaction immunitaire suivie d’une inflammation dirigée contre ses propres cellules. « Une analyse du sang a confirmé une induction anormale d’interféron de type 1 chez ces patients, indique Alice Lepelley. De manière inattendue, un séquençage du génome chez deux patients a également révélé la présence de variants du gène ATAD3A, associés depuis 2016 à une maladie mitochondriale ». Il n’en fallait pas moins aux chercheurs pour voir le potentiel clinique d’une telle découverte et investiguer davantage le mécanisme à l’œuvre.
Ils ont donc identifié d’autres patients avec des mutations du gène ATAD3A, présentant eux aussi une suractivation de la voie de signalisation de l’interféron dans le sang. Puis, ils ont mis en culture des cellules de la peau (fibroblastes) issues des patients qu’ils ont ensuite testées et analysées. Résultat : les variants génétiques du gène ATAD3A provoquent bel et bien la libération d’ADN mitochondrial dans le cytoplasme, induisant l’accumulation d’interférons de type 1 dans les fibroblastes. « C’est la première fois que l’on met en évidence ce mécanisme avec de l’ADN mitochondrial, précise Alice Lepelley. Ces nouveaux cas cliniques nous font penser que les associations entre maladies mitochondriales et interféronopathies sont sans doute plus fréquentes qu’on ne le pense ».