Publié le 30.11.2020
Si de l’extérieur, les animaux vertébrés paraissent symétriques à droite et à gauche, à l’intérieur c’est bien différent : d’une part la position des organes dans le corps est asymétrique, et ces mêmes organes sont eux-mêmes souvent asymétriques.
Premier organe à entrer en fonction, le cœur, sujet de prédilection du laboratoire Morphogenèse du Cœur que dirige Sigolène Meilhac à l’Institut Pasteur et à l’Institut Imagine, n’échappe pas à cette règle. Avec son équipe, Sigolène Meilhac cherche à savoir comment il se forme et comment se met en place cette asymétrie. « C’est une question d’autant plus importante que la forme du cœur conditionne sa fonction » explique la chercheuse.
Un cœur, Deux pompes
Le cœur peut s’assimiler à deux pompes : celle de droite qui envoie le sang pauvre en oxygène dans les poumons et la pompe gauche qui distribue le sang riche en oxygène aux autres organes. Ces deux compartiments cardiaques doivent être totalement étanches. Sinon les sangs se mélangent, et l’oxygénation est insuffisante pour le bon fonctionnement des organes.
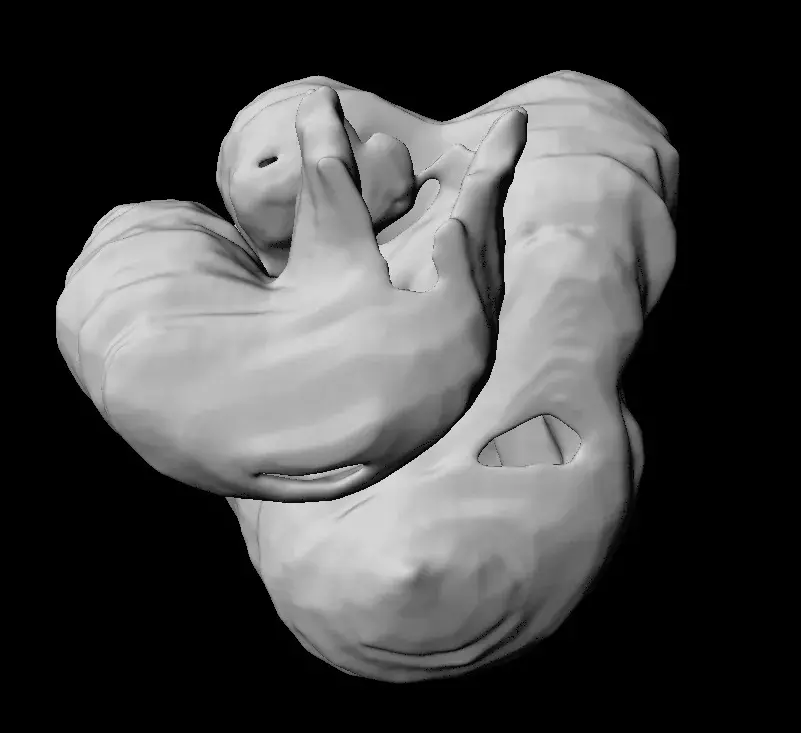
« Ce cloisonnement du cœur, qui assure la double circulation du sang, repose sur un événement asymétrique qui a lieu dans l’embryon durant les 20 à 28 premiers jours de grossesse, note Audrey Desgrange, post-doctorante dans le laboratoire Morphogenèse du Cœur. A ce moment-là, l’ébauche du cœur est un tube, et il va s’enrouler un peu comme une hélice de coquille d’escargot. Cette étape est fondamentale pour l'alignement des chambres cardiaques et le cloisonnement du cœur. »
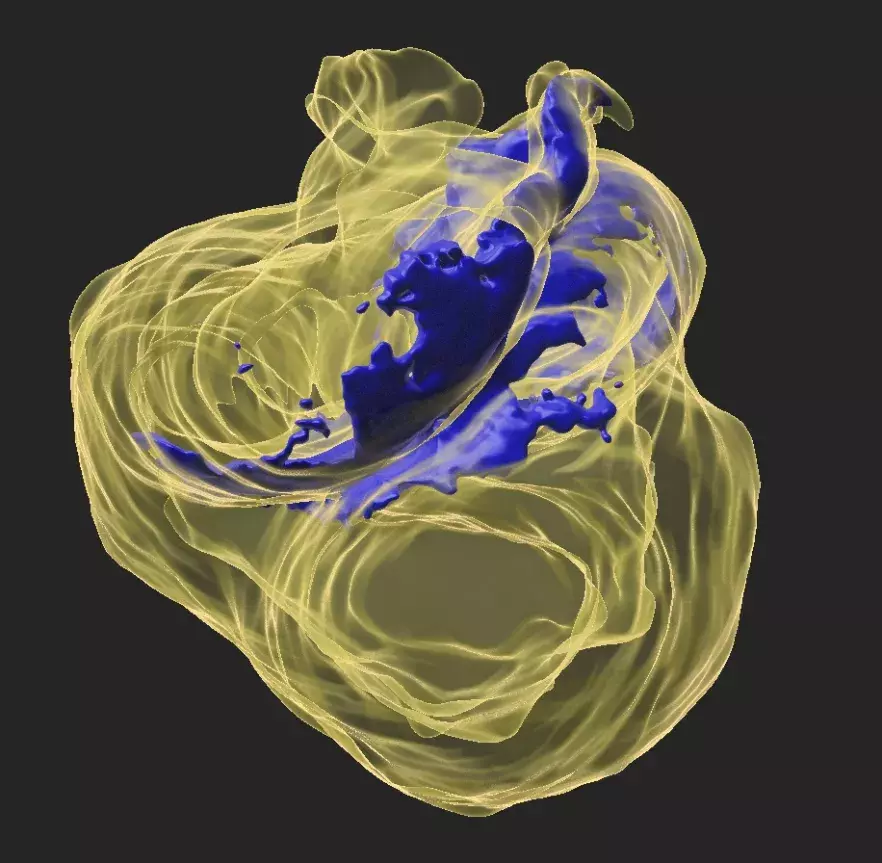
Dans leur dernière publication dans Developmental Cell, le laboratoire de Sigolène Meilhac a observé en 3D cette transformation du tube dans l’embryon de souris, en suivant tout particulièrement un acteur de l’asymétrie, le gène Nodal. « Nodal est connu de longue date pour définir le côté gauche de l’organisme, rappelle Sigolène Meilhac. Nous avons observé que son action était transitoire et précoce dans les cellules cardiaques, avant que le cœur ne commence à battre. »
En l’absence de Nodal, le tube cardiaque embryonnaire est toujours courbé, mais l’hélice est de travers, ce qui conduit à des malformations cardiaques à la naissance, caractéristiques du syndrome d’hétérotaxie. « Pour comprendre pourquoi l’hélice était anormale, nous avons combiné des simulations informatiques et des analyses moléculaires dernier cri » décrit Audrey Desgrange. Si l’initiation de l’asymétrie du cœur est indépendante de Nodal, celui-ci joue toutefois un rôle important : il oriente et sculpte la courbure pour que le tube cardiaque embryonnaire prenne une forme d’hélice.
Bien que ces travaux montrent que Nodal n’est pas le seul régulateur de l’asymétrie, son rôle reste majeur dans le cloisonnement final du cœur, nécessaire à la mise en place de la circulation sanguine.
Les chercheuses poursuivent donc l’exploration du cœur embryonnaire avec en tête l’idée de démontrer l’origine de malformations congénitales du cœur et ainsi contribuer à une meilleure prise en charge des patients et information des familles.