Publié le 01.07.2025
Présentation

Contact
(+33) 1 42 75 43 56
Notre groupe vise à identifier les principaux gènes et les variants correspondantes impliqués dans le déterminisme des maladies infectieuses fréquentes. Il participe également à l'élaboration de méthodes statistiques en génétique humaine, car les analyses de données soulèvent souvent des questions méthodologiques que nous cherchons ensuite à résoudre. En particulier, nous avons développé plusieurs approches pour améliorer et optimiser l'analyse des données de séquençage NGS. Nos études sur les maladies infectieuses portent principalement sur les infections causées par des mycobactéries virulentes et certains virus oncogènes.
Parmi nos principaux résultats de ces dernières années, on peut citer :
1. Dans la lèpre, après l'identification par clonage positionnel de deux variants majeurs de la susceptibilité à la lèpre (dans les gènes PARK2/PACRG et LTA), nous avons réussi à reproduire et à affiner le rôle de certains allèles HLA-C, ainsi que le rôle de variants dans des gènes également impliqués dans la maladie de Crohn, validant ainsi le recoupement au niveau du contrôle génétique de cette maladie avec la lèpre.
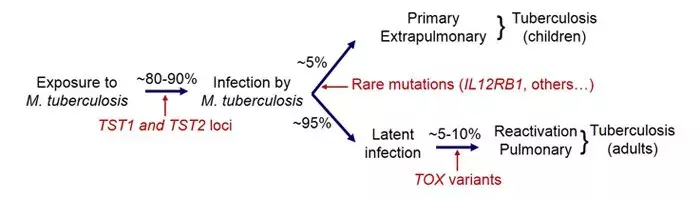
2. Dans la tuberculose (TB), nous avons identifié des variants du gène TOX qui sont fortement associés au développement précoce de la tuberculose pulmonaire (avant 25 ans). En outre, nous avons découvert des cas de prédisposition mendélienne chez les enfants atteints de tuberculose, suite à des mutations dans le gène TYK2 en particulier. Enfin, nous avons récemment montré que la réplication du locus TST1 était impliqué dans la résistance à l'infection tuberculeuse dans des populations d'origine ethnique différente.
3. En ce qui concerne l'infection par le virus de l'hépatite C (VHC), nous avons effectué la première étude d'association pangénomique (GWAS) sur la fibrose hépatique causée par une infection chronique par le VHC. Nous avons identifié plusieurs loci de susceptibilité à la fibrose hépatique induite par le VHC associés à la voie de l'apoptose, ce qui a permis de mieux comprendre les mécanismes qui sous-tendent le développement de la fibrose et a ouvert la voie à de nouvelles stratégies thérapeutiques.
4. D'un point de vue méthodologique, nous avons étendu les tests d'association pangénomique basés sur la famille pour tenir compte des variants mis au jour par les analyses GWAS. Plus récemment, nous avons mis au point des méthodes pour faciliter l'interprétation et l'identification des mutations responsables de la maladie à partir de données NGS de patients atteints de la même maladie. Nous avons également montré que le séquençage du génome entier (WGS) était plus puissant que le séquençage de l'exome entier (WES) pour la détection de variants exoniques.
Nous étendons nos travaux sur la tuberculose et la lèpre en étudiant de nouveaux phénotypes (sujets très résistants à l'infection par la tuberculose et aux réactions d'inversion dans la lèpre) en collectant de nouveaux échantillons. Nous avons un projet en cours sur l’analyse génétique de l'ulcère de Buruli, la troisième maladie mycobactérienne la plus courante. Nous poursuivrons nos travaux sur les complications les plus graves liées au VHC et au VHB, telles que la cirrhose du foie et le carcinome hépatique. Notre stratégie combine une anlyse de gènes candidats à des approches pangénomiques (GW). En particulier, nous étudions actuellement le rôle de variants rares ayant de forts effets individuels en utilisant les études WES et WGS, ce qui nécessite le développement de méthodes d'analyse spécifiques. Tous ces projets sont réalisés dans le cadre de grandes études de terrain que nous coordonnons et auxquelles participent de nombreux collaborateurs.
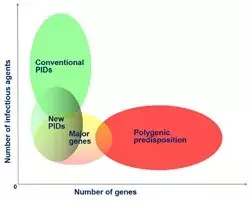
Avec l'autre groupe de recherche du laboratoire (JL Casanova), nous étudions également le contrôle génétique de certaines de ces infections du point de vue de la prédisposition mendélienne à des phénotypes rares (par exemple, tuberculose grave ou hépatite fulminante) et de la prédisposition complexe à des phénotypes communs (par exemple, tuberculose pulmonaire ou infection par le VHC/VHB). L'identification des gènes de l'hôte impliqués dans les maladies infectieuses humaines fournira de nouvelles clés pour comprendre les mécanismes de pathogénèse à l’origine du développement des maladies, avec des implications pratiques potentiellement importantes pour le contrôle des maladies infectieuses.
Equipe
Ressources & publications
-
 2020Journal (source)Science
2020Journal (source)ScienceAuto-antibodies against type I IFNs in patients with life-threatening COVID-19.
-
 Journal (source)Proc. Natl. Acad. Sci. U.S.A.
Journal (source)Proc. Natl. Acad. Sci. U.S.A.Common homozygosity for predicted loss-of-function variants reveals both redu...
-
 2020Journal (source)J. Clin. Invest.
2020Journal (source)J. Clin. Invest.Inherited human IFN-γ deficiency underlies mycobacterial disease.
-
 2019Journal (source)J. Exp. Med.
2019Journal (source)J. Exp. Med.Inherited IFNAR1 deficiency in otherwise healthy patients with adverse reacti...
-
 2019Journal (source)Front Genet
2019Journal (source)Front GenetIdentification of an Endoglin Variant Associated With HCV-Related Liver Fibro...
-
 2019Journal (source)Nat. Rev. Immunol.
2019Journal (source)Nat. Rev. Immunol.A novel genetic architecture of infectious diseases.
-
 2019Journal (source)J. Exp. Med.
2019Journal (source)J. Exp. Med.Severe influenza pneumonitis in children with inherited TLR3 deficiency.
-
 2019Journal (source)Bioinformatics
2019Journal (source)BioinformaticsPopViz: a webserver for visualizing minor allele frequencies and damage predi...
-
 Journal (source)Proc. Natl. Acad. Sci. U.S.A.
Journal (source)Proc. Natl. Acad. Sci. U.S.A.Homozygous NLRP1 gain-of-function mutation in siblings with a syndromic form ...
-
 2019Journal (source)Sci Immunol
2019Journal (source)Sci ImmunolTuberculosis and impaired IL-23-dependent IFN-γ immunity in humans homozygous...
-
 2019Journal (source)PLoS ONE
2019Journal (source)PLoS ONEPrevalence and risk factors for latent tuberculosis infection among healthcar...
-
 Journal (source)Proc. Natl. Acad. Sci. U.S.A.
Journal (source)Proc. Natl. Acad. Sci. U.S.A.Pleiotropic effects for Parkin and LRRK2 in leprosy type-1 reactions and Park...
-
 2019Journal (source)Nucleic Acids Res.
2019Journal (source)Nucleic Acids Res.SeqTailor: a user-friendly webserver for the extraction of DNA or protein seq...
-
 2019Journal (source)Sci Rep
2019Journal (source)Sci RepAn eQTL variant of ZXDC is associated with IFN-γ production following Mycobac...
-
 2019Journal (source)Elife
2019Journal (source)ElifeIRF4 haploinsufficiency in a family with Whipple's disease.
-
 Journal (source)Proc. Natl. Acad. Sci. U.S.A.
Journal (source)Proc. Natl. Acad. Sci. U.S.A.Blacklisting variants common in private cohorts but not in public databases o...
-
 2019Journal (source)Lancet Infect Dis
2019Journal (source)Lancet Infect DisGenetics of human susceptibility to active and latent tuberculosis: present k...
-
 2018Journal (source)Semin. Immunol.
2018Journal (source)Semin. Immunol.Human genetics of infectious diseases: Unique insights into immunological red...
-
 2018Journal (source)N. Engl. J. Med.
2018Journal (source)N. Engl. J. Med.HCV-Associated Liver Fibrosis and HSD17B13.
-
 Journal (source)Proc. Natl. Acad. Sci. U.S.A.
Journal (source)Proc. Natl. Acad. Sci. U.S.A.Incomplete penetrance for isolated congenital asplenia in humans with mutatio...
-
 2018Journal (source)PLoS Negl Trop Dis
2018Journal (source)PLoS Negl Trop DisMicrodeletion on chromosome 8p23.1 in a familial form of severe Buruli ulcer.
A lire également
-

Accélérer la recherche
09/03/2023
Identification d’un nouveau gène en cause dans les allergies et l’eczéma sévères
-

Accélérer la recherche
23/05/2022
Les causes génétiques des infections graves à staphylocoques
-
Accélérer la recherche
19/05/2022
Covid-19 et auto-anticorps : l'influence de l'âge sur la mortalité
-

Accélérer la recherche
01/02/2022
Covid-19 : Une revue pour comprendre les facteurs génétiques et immunologiques responsables des pneumopathies